细胞工程
生物工程(bioengineering)是指用生物体或其组成成分在最适条件下产生有益产物及进行有效生产过程的技术,所以又称为生物技术(biotechnology)。如今它已包含有基因与基因组工程、酶工程、发酵工程、细胞与组织工程、生化工程、微生物工程等诸多方面。
细胞工程(cell engineering),顾名思义,是将细胞生物学知识与生物工程学技术相结合而形成的一门新的学科领域。具体说来,它主要是通过细胞融合或拆合、核质交换或核移植、染色体或基因转移以及经由细胞培养和筛选,按照人们预先的设计,产生出新的细胞,并最终用于生产或医疗实践,或进行更深层次的研究及开发。
组织工程(tissue engineering)则更强调利用生物学和工程学的原理与技术,研究与开发出可修复或取代人体的组织或器官,用于医学实践。种子细胞、支架材料和调控因子是构成组织工程的三大要素。因此,细胞工程是组织工程的基础之一。
细胞工程在技术程序中避免了基因分离、提纯、剪切、拼接等分子水平的操作,一般只需将细胞遗传物质直接转移到受体细胞即可形成杂交细胞,因此,其过程相对比较简捷,不致造成对受体细胞的较大损伤,同时转移效率提高。此外,细胞工程不仅可以在动物之间、植物之间、微生物之间进行,还可以在动物与植物间、动物与微生物间、植物与微生物之间进行,从而可产生新的品种,甚至物种。
目前,根据操作对象不同,细胞工程又分为动物细胞工程、植物细胞工程以及微生物细胞工程,本章介绍动物细胞工程。
细胞工程涉及面很宽,所用技术方法也很多,但就总体来说,细胞工程可以认为是不同层次上的细胞拆合与重组工程。这些层次是细胞整体层次,如细胞培养、细胞融合、细胞重编程;细胞器层次,如核移植;以及分子层次,如基因转移等。
一、大规模细胞培养
细胞培养是细胞工程中最基本、最常用的技术之一。有关细胞培养的基本原理以及基本过程已在第三章叙述。本节只介绍大规模细胞培养。所谓大规模细胞培养(large scale cell culture)是指细胞的高密度(density)或高浓度(concentration)培养,培养容量在2L以上,需要借助细胞培养容器,目的是制备大量的细胞或是以此来生产更多的细胞产物。目前,大规模细胞培养的方法很多,大致可分为悬浮细胞培养和贴壁细胞培养两大体系。但在实际应用中,常分为悬浮培养、固定化培养和微载体培养三种方法。
二、细胞融合
细胞融合(cell fusion),又称细胞杂交(cell hybrid ization),是指2个或2个以上的细胞合并成1个细胞的过程,所产生的细胞称杂交细胞(hybrid)。
该过程涉及质膜的连接与融合,胞质合并,染色体、细胞器以及各种胞质成分的混合。基因型相同的细胞融合所形成的杂交细胞称为同核体(homokaryon),基因型不同的细胞融合所形成的杂交细胞称为异核体(heterokaryon)。
细胞融合技术的不仅为研究细胞的遗传变异、进化、发育等基础研究提供了有利的方法,而且它也是细胞工程的重要工具。因为借此技术,人们可以在种内、种间、甚至动植物间进行细胞融合,产生新的品种,甚至物种,更可以借此生产单克隆抗体这样的生物制剂,用于临床实践。
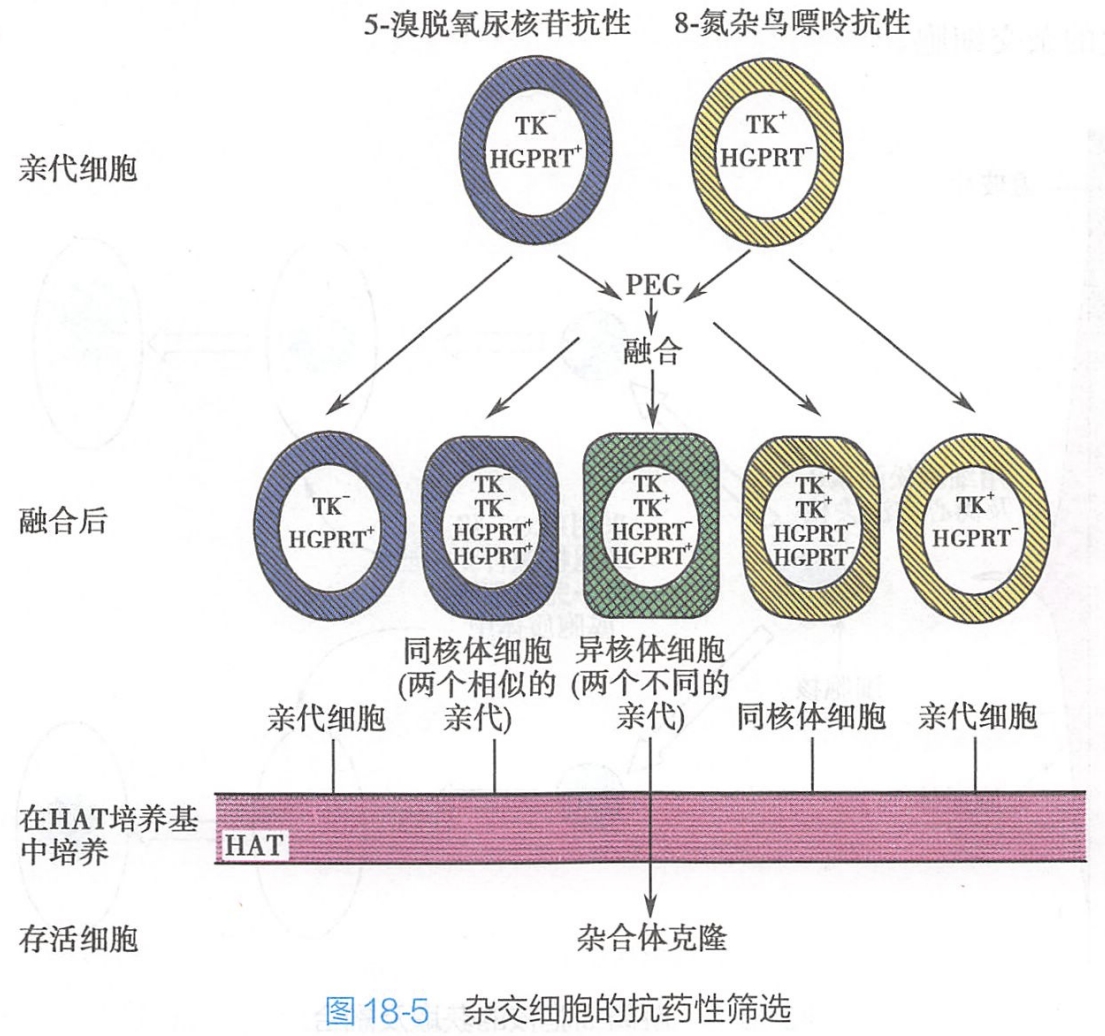
细胞融合是否成功最为关键的技术之一在于对杂交细胞的筛选,即挑选出所需要的杂交细胞。通常有下列三种方法:
(一)抗药性筛选
常用HAT培养基筛选。HAT是由次黄嘌呤(hypoxanthino,H)、氨基蝶呤(amin opterin,A)和胸腺嘧啶脱氧核苷(thymidine,T)组成的培养基,其原理是当一种胸腺嘧啶核苷激酶缺陷(TK)细胞与次黄嘌呤鸟嘌呤磷酸核糖转移酶缺陷(HGPRT)细胞融合后所得的是一种既含有TK酶又含有HGPRT酶的杂交细胞,只有这两种基因互补的细胞才具有在HAT选择培养基中存活下来的能力(图18-5)。 #生化
(二)营养缺陷筛选
某些细胞在缺乏某种营养成分的培养基中不能存活,称之为营养缺陷型细胞,如5-溴脱氧尿嘧啶核苷(5-bromouridine deoxyribose)缺陷(BUdR-)细胞。因此可以利用分裂细胞 DNA中因掺入有BUdR而对紫外线更敏感的特性,先用光照来杀伤未融合细胞,再将存活下来的缺陷型细胞培养于完全培养基中使其增殖生长。
(三)温度敏感筛选
正常哺乳动物细胞可在32~40℃环境中存活,最适温度为37~38℃。利用化学诱变的方法可使细胞发生突变,然后用非允许温度即38~39℃进行筛选,让温度敏感突变型细胞存活下来,这样的细胞株称为热敏感突变株。
反之,我们也可用低温来筛选,所得到的细胞为冷敏感突变株。温度敏感突变的机制在于温度依赖性基因的产物只有在一定的温度下才具有功能,非此温度没有活性。
三、细胞核移植
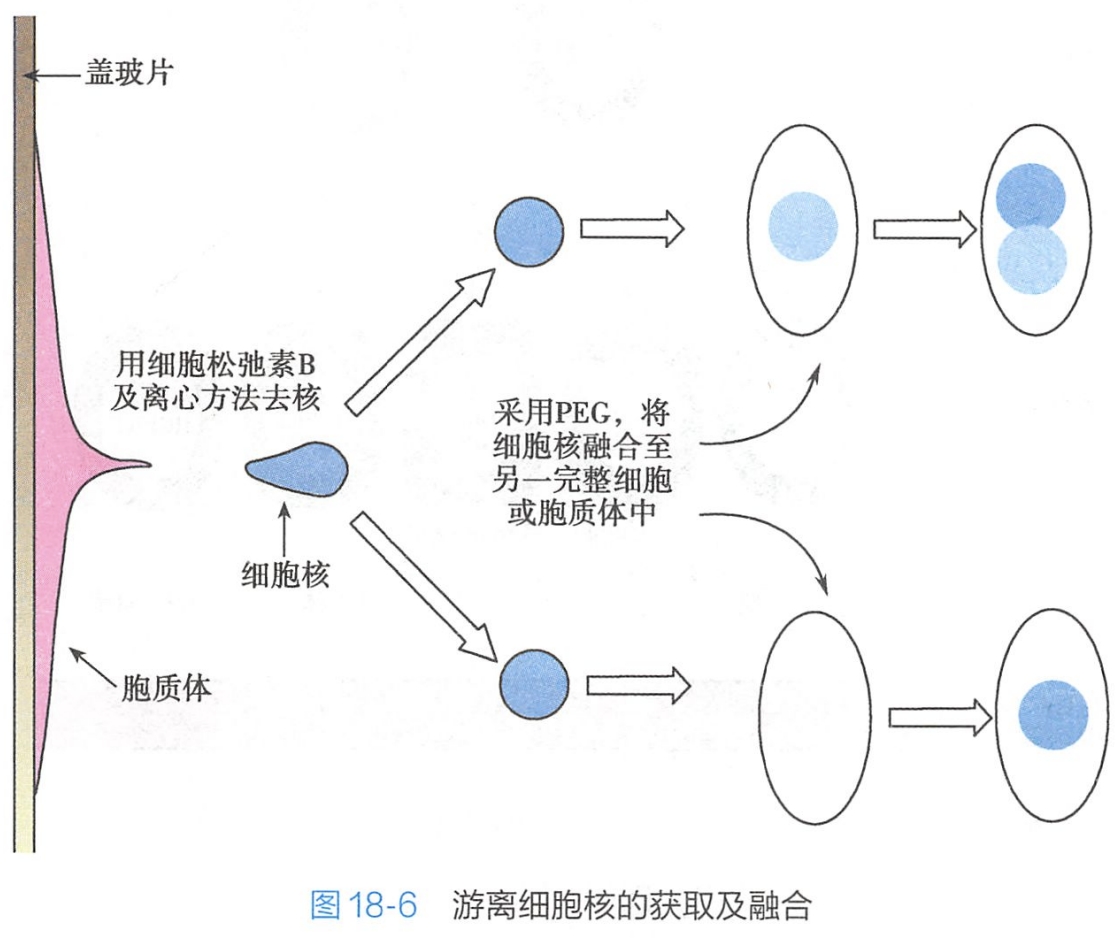
细胞核移植(nuclear transfer)是指通过显微操作(micromanipulation)将一个细胞的细胞核移植到一个去核的卵母细胞内的技术过程。1963年,我国科学家童第周将金鱼的囊胚细胞核植入去核的未受精卵内,首次得到了克隆鱼。在细胞核移植方法方面,除了可用显微操作仪(micromanipulator)外,利用游离的细胞核也可进行(图 18-6),即用细胞松弛素(cytochalasin)处理细胞结合离心方法使细胞脱核,然后经PEG将该细胞核融合进另一完整的细胞中,或者融合入一个胞质体内,这种杂交细胞称为胞质杂种(cybrid),以别于有核间融合所产生的杂交细胞。
在核移植的研究与实践中,最令人瞩目的是克隆羊多利(Doly)的出生。该克隆羊的产生过程如图18-7所示。
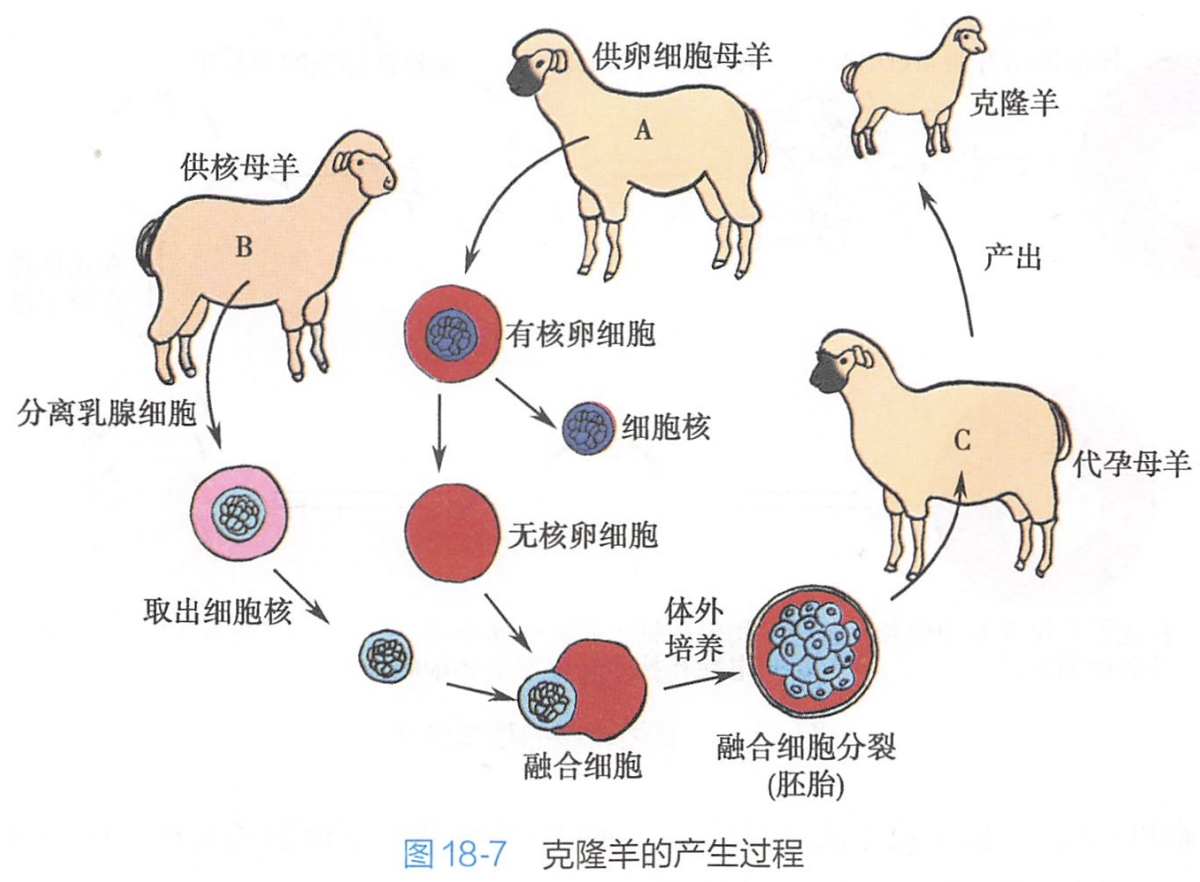
首先从一个苏格兰母羊(A)体内取出卵母细胞,将其核去掉成为无细胞核的卵细胞。再从另一头芬兰母羊(B)的乳腺上皮分离得到体细胞,将其细胞核取出,然后让它与上述去核的卵细胞融合,产生杂交细胞,这种杂交细胞在体外可以发育至囊胚期,然后再将该囊胚(胚泡)植入另一头苏格兰母羊(C)的子宫内,最后生产出小羊。由于该小羊的遗传特性来源于供核母羊(B),该小羊是供核母羊的克隆。母羊(A)主要是提供了细胞核发育所需的营养与环境,而母羊(C)只是“代孕”母亲。
该过程称为体细胞核移植(somatic cell nuclear transfer)。多利羊的成功在理论上具有重要意义,即证明高度分化的成体体细胞核在成熟卵母细胞中仍然可以被激活并且重新编程(reprogramming);另外,它还可以发育成为一个完整的个体。因此,这种核仍然具有分化全能性(totipotency),但是该细胞核-质间的相互作用过程及机制尚未完全阐明。
随着干细胞技术和核移植技术的快速发展,科学家成功制备了核移植胚胎干(nuclear-transfered embryonic stem,ntES)细胞。尽管ntES细胞像ES细胞一样来自囊胚的内细胞团,具有多分化潜能和高增殖特性,可以向任何一种胚层的细胞发育,但是,它与传统意义上的胚胎干细胞具有很大的区别。
ntES细胞来自核移植胚胎而不是正常发育的胚胎,ntES的遗传物质与供体核完全一致,所以,ntES移植到供核体体内,理论上不会引起免疫排斥反应。
除了理论意义外,体细胞核移植技术更是细胞工程领域中的一个极为重大的突破,因为借此技术人们可以进行同种动物克隆以及异种间的克隆,还可以进行同源克隆(homologous cloning),即将一个个体的体细胞核植入同一个体的去核的卵母细胞中,由此获得的干细胞植入供核(也供卵母细胞)供体体内不发生免疫排斥。因此,具有极大的细胞治疗价值。
例如,治疗性克隆(therapeutic cloning)是胚胎干细胞技术与核移植技术相结合,用于产生疾病替代治疗细胞的新技术。它以患者的体细胞核为供核,将重构胚培育至囊胚,从内细胞团中分离出ES细胞,为患者提供与其自身遗传物质一致的组织细胞或器官用于疾病治疗,这样就可以避免异种或同种间细胞/器官移植的免疫排斥反应。该技术使许多目前医学上没有有效治疗方案的疾病获得了重新治愈的可能。
另一个核移植技术的应用是生殖性克隆(reproductive cloning),指的是体细胞核移植后,任其发育直至产生一个新个体。多利绵羊即是通过生殖性克隆产生的。生殖性克隆技术应用于人类的实践即为克隆人。对此,世界多数国家,包括我国政府均坚决反对,但赞同治疗性克隆的研究,因为它可以造福多种疾病的广大患者。
四、基因转移
基因转移(gene transfer)指的是将外源基因导入受体细胞并整合至受体细胞的基因组中,使受体细胞遗传性状及表型发生一定改变的技术。借此过程人们可以选择出所需的新型细胞,乃至新的个体。若外源基因不但能在动物体内表达,并且可以遗传,则该动物称为转基因动物(transgenic animal)。
一般说来该技术包括如下过程:
- 选择与提取外源目的基因;
- 用一定的方法将外源目的基因导入受体细胞;
- 对整合有目的基因的细胞进行筛选、扩增及鉴定;
- 若受体为卵细胞,则进行体外培育,并植入合适的动物子宫内;
- 筛选并获得转基因动物以及进行后续的所需研究。由上可知,基因转移是获得转基因动物的核心技术,图18-8示基因转移的基本步骤。
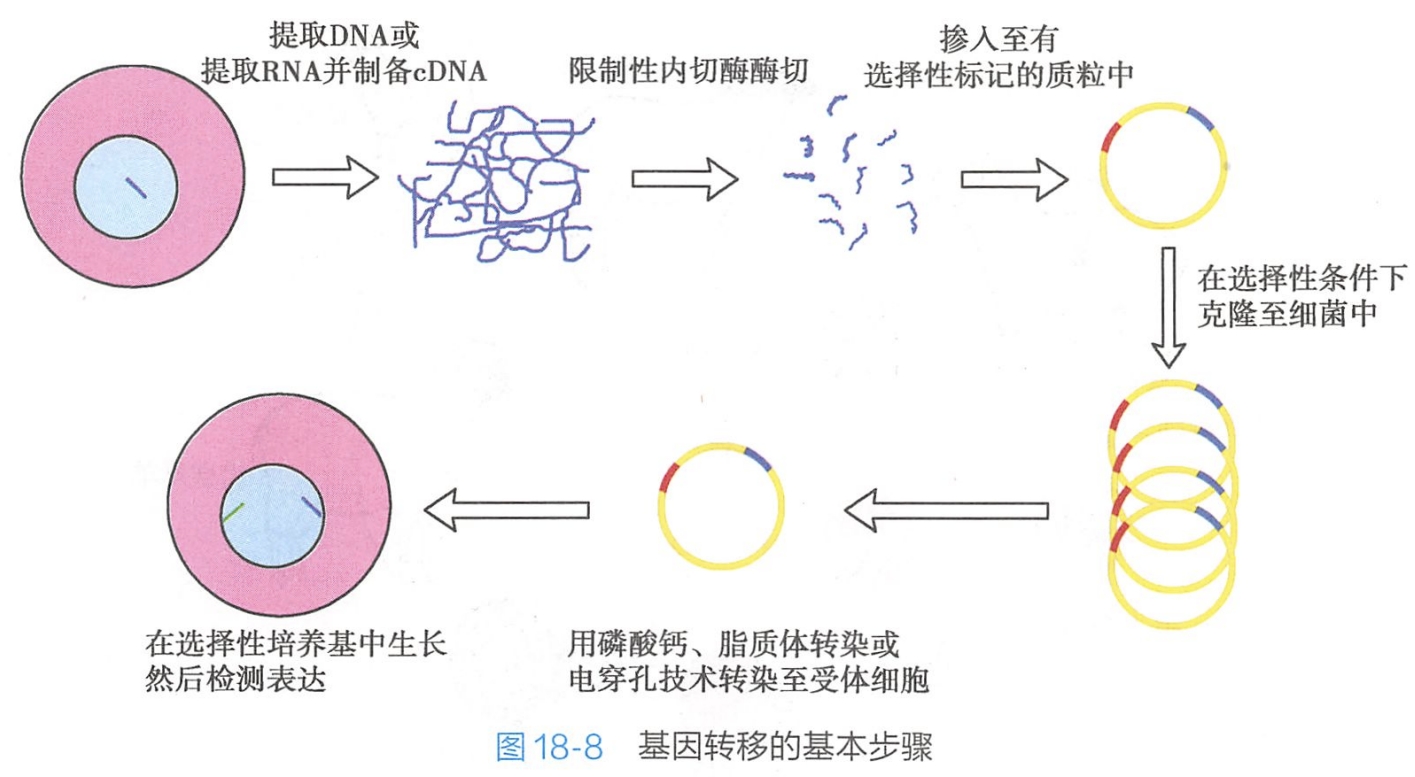
基因转移的方法很多,通常可分为:
- 物理学方法,包括电穿孔法、显微注射法、裸DNA直接注射法等;
- 化学方法,包括DEAE-葡聚糖法、磷酸钙共沉淀法、脂质体包埋法等;
- 生物学方法,包括病毒介导法、体细胞核移植法、精子载体法以及胚胎干细胞转染法等。下面简述几种常用的外源基因导入受体细胞的技术,即细胞转染(transfection)技术。
(一)磷酸钙介导的转染
磷酸钙将外源基因导入哺乳动物细胞,该方法操作简单,无需昂贵的设备,迄今仍被实验室广泛采用。
其原理及基本过程是将氯化钙与外源DNA混合,然后加入到含磷酸根离子的溶液中,即可形成钙-磷酸-DNA共沉淀物;接着,该沉淀物可被培养的细胞内吞摄取进入细胞质,随后进入细胞核,DNA整合入细胞基因组中,并最终得到表达。多种因素可以影响磷酸钙介导的转染效率,其中包括细胞的生长状态(一般以70%汇合为佳)、外源质粒DNA的纯度、所形成的磷酸钙沉淀颗粒的大小以及溶液pH。为了保证DNA的高纯度、无内毒素,常通过阴离子交换层析提纯或CsCl离心纯化DNA。
(二)脂质体介导的转染
阳离子脂质体介导的细胞DNA转染方法,其原理及基本过程是以一种多价阳离子脂质体(lipofectamine)取代单价阳离子载体,当DNA与脂质体通过离子相互作用时,可被阳离子单层脂质体包被形成复合物,该复合物可与培养细胞的细胞膜融合,使DNA进入细胞并整合至受体细胞的基因组中得以表达。阴离子脂质体也可作为细胞转染的试剂。
与其他转染方法相比,阳离子脂质体的主要优点在于转染成功率较高,70%~80%的离体细胞均可瞬时表达外源基因。该方法用于大片段DNA、RNA、寡聚核苷酸等转染,具有适应性广,细胞毒性较低的优点。但脂质体作转染试剂比较昂贵,不利于大规模使用。
(三)电穿孔法
当把高浓度细胞悬液短暂地暴露于高压脉冲电流时,DNA可通过高电压在细胞膜上所形成的可复性小孔进入细胞质内,然后整合入细胞的基因组并得到表达。电穿孔方法可用于对化学法转染不敏感的细胞。
在实践中,一般选择恒定的脉冲,在室温下进行电穿孔,即在500~1500kV/cm的场强下轰击细胞;然后将细胞置于冰上,以延长细胞膜孔道的开放时间。一般情况下,经轰击后能有20%~50%的细胞可以存活下来。由于贴壁生长的细胞必须附着在培养皿表面才能生长,因此,与贴壁生长的细胞相比,悬浮细胞更适合用电穿孔法进行转染。
另外,该方法所需的细胞及DNA要比化学法更多,而且不同细胞间的最佳转染参数差异较大,因此常须摸索最适实验条件。
(四)病毒感染法
这是一种通过病毒感染途径将外源目的基因导入受体细胞的方法。根据受体细胞的类型不同,可选择具有不同宿主范围和不同感染途径的病毒基因组作为转染载体。常用的病毒载体包括 DNA病毒载体(腺病毒载体、腺相关病毒载体、牛痘病毒载体等)和RNA病毒载体(逆转录病毒载体、慢病毒载体等)。
用作基因转染的病毒载体均为复制缺陷型病毒,感染细胞后仅能将基因组整合至细胞,但不能产生包装的病毒颗粒。在各类病毒载体中,比较常用的是逆转录病毒载体和腺病毒载体。
逆转录病毒(retrovirus)是一种单链RNA病毒,它进入细胞后,在反转录酶作用下,RNA反转录为DNA,由于反转录病毒的长末端重复序列(LTRs)具有转录启动子的活性,因此将外源DNA连接到LTRs下游可进行重组,再包装为高滴度的病毒颗粒;转染方法为病毒直接感染细胞,或者注射病毒至动物体内,携带外源基因的反转录病毒DNA便可整合入受体的基因组内。诱导多能干细胞即是利用逆转录病毒作为载体将Oct3/4、Sox2、c-myc和Klf4导入小鼠成体细胞而获得的。
腺病毒(adenovirus)为线型双链DNA,无包膜,其优点是安全性好,不整合入人染色体,不会导致肿瘤发生。此外适用的受体细胞广,有多种血清型(serotypes)选择。外源基因在载体上容易高效表达。
(五)显微注射法
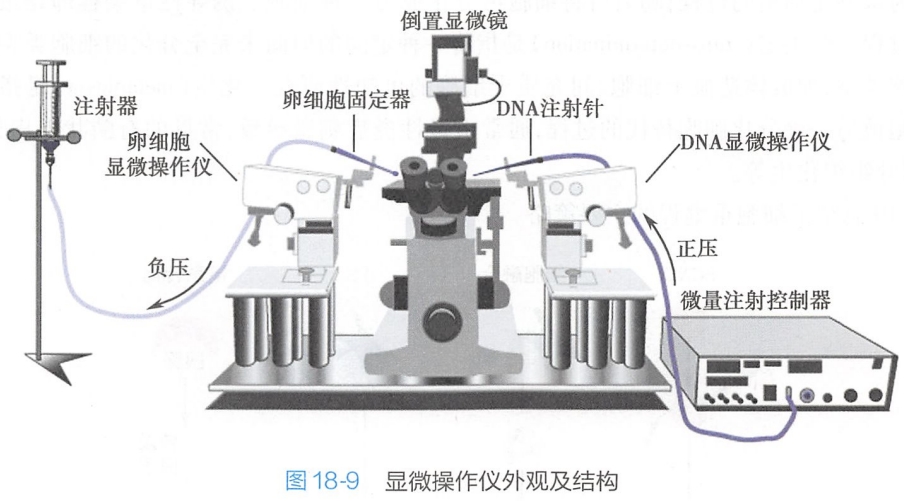
该方法主要用于制备转基因动物,即在显微操作仪下,实验人员通过玻质注射针将DNA迅速注入受精卵内,通常注入雄性原核内或者在其附近,然后将受精卵移植至假孕动物的输卵管中,最后产生转基因动物。
该方法需要装备较昂贵的显微操作仪(图18-9),操作人员必须经过培训方能操作自如,保证一定的成功率。此外,由于成熟卵母细胞数量少,需用超数排卵(superovulation)技术方能获得较多的卵以供实验。
五、细胞重编程
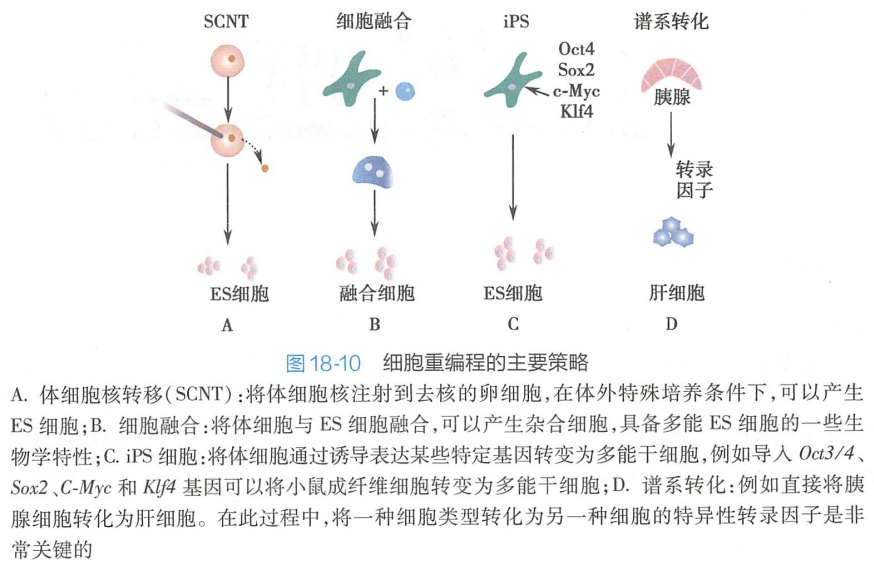
细胞重编程(cellular reprogramming)是指已分化细胞的核基因组恢复其分化前的功能状态。该技术是不改变基因序列的情况下,通过表观遗传修饰如DNA甲基化来改变细胞的命运,分为多能性重编程和谱系重编程两大类。
利用多能性重编程技术获得的诱导型多能干细胞,或谱系重编程技术获得的组织干细胞或组织细胞,既具有类似胚胎干细胞的多能性,又避开了胚胎干细胞应用的伦理学限制,同时具有患者特异性或疾病特异性,可显著减少免疫反应,因而极大程度缩短药物研发进程,并使细胞治疗的临床应用成为可能。
(一)多能性重编程
多能性重编程(pluripotent reprogramming)是指已分化细胞在特定条件下去分化恢复到全能性或多能性状态,通常可采取核移植、细胞融合、多能细胞提取物共培养以及诱导性重编程等手段实现。
其中,诱导性重编程是细胞重编程的一项重大进展,为干细胞研究领域,乃至整个生命科学领域带来了概念性的革新。其他重编程技术,如核移植技术涉及伦理问题;而细胞融合方法即将体细胞与胚胎癌细胞、胚胎生殖细胞或者胚胎干细胞进行细胞融合方法得到的重编程细胞是四倍体,存在很大程度的基因组不稳定;使用多能细胞提取物与体细胞共培养依然需要干细胞,依然不能克服伦理学问题。
2006年,日本京都大学Yamanaka实验室利用逆转录病毒介导,将4种转录因子OCT3/4、SOX2、cmyc和Klf4导入小鼠分化细胞中,成功逆转了分化过程并得到功能上类似胚胎干细胞的细胞,将其命名为诱导多能干细胞(induced pluripotent stem cell,iPSC)。
iPSC对医学领域最直接的贡献在于为疾病研究提供了体外模型。一方面,利用从患者身上建立iPSC疾病模型,可以简化疾病模型建立过程,用于疾病发病机制研究;另一方面,iPSC可以为新药开发提供评价模型,用于测试候选药物的疗效毒性等。2014年,日本进行了世界首例iPSC应用的临床研究。科学家将iPSC分化出的视网膜色素上皮细胞移植到患者体内,用于治疗老年性黄斑,这是重编程细胞首次移植到人体内,展示了iPSC在临床疾病治疗方面应用前景。
(二)谱系重编程
谱系重编程(lineage reprogramming)指不经过多能性干细胞阶段,直接将已经分化的成熟细胞(或祖细胞)转换为另外一种成熟细胞或干/祖细胞的重编程策略,包括转分化、去分化、转决定、特定类型的化生等。
转分化(trans-differentiation)是指直接将一类已分化细胞重编程为另一类已分化细胞,且不经过多能性细胞阶段,也称为谱系转换。
去分化(de-differentiation)是指已分化细胞失去原有的分化结构和功能成为未分化细胞的过程;随后可将细胞再分化成另一种细胞。诱导性重编程即是最彻底的一个去分化过程。
转决定(trans-determination)是指将一种定向的但尚未完全分化的细胞类型重编程为另一种细胞类型,如成体造血干细胞、间充质干细胞的可塑性研究。
化生(metaplasia)是指组织中一种分化细胞被另一种分化细胞替代的过程,通常由慢性炎症刺激导致,常见的有鳞状上皮化生、肠上皮化生、间叶组织化生等。 #病理
图18-10总结了细胞重编程的主要策略。